8月30日晚间,君实生物发布2022年半年报由于营业收入无法覆盖R&D费用和其他费用,公司2022年上半年净利润亏损9.12亿元
君实生物表示,报告期内,公司实现营业收入约9.46亿元虽然生产经营受到上海等地疫情的一定影响,但公司积极应对复杂形势,坚持各项业务有序推进报告期内,公司研发投入约10.62亿元,近10个创新药物临床试验申请获得NMPA或FDA批准
PD—1销量走出低谷
君生物是一家创新驱动的生物制药公司,拥有从创新药物的发现研发,全球临床研究,量产到商业化的全产业链完整能力目前君实生物正在研发的产品有三个,分别是Tereplizumab,Etsevizumab和adalimumab
作为首个获批的国产PD—1,Tereplizumab的商业化之前经历了多次调整最后,在去年底和今年年初完成商业化团队的重组和优化后,Tereplizumab的销量正在逐渐走出低谷
Tereplizumab的国内销售逐渐恢复,开始进入正循环公司对Tereplizumab未来的商业化充满信心君生物在半年报中表示
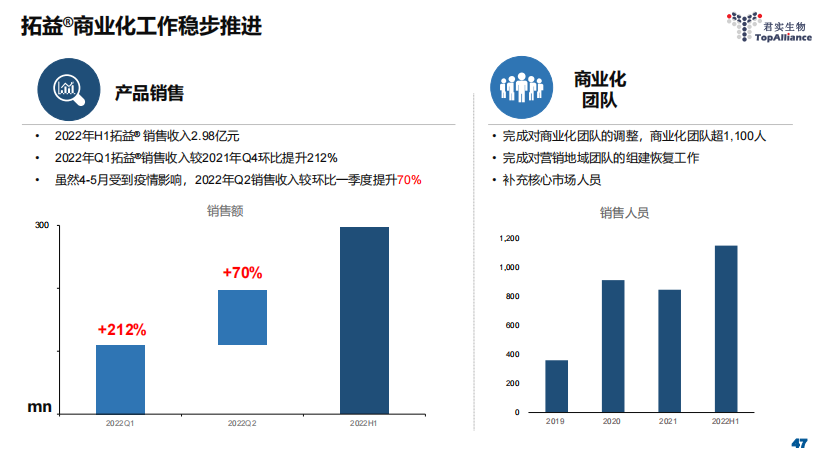
财报显示,上半年国内市场实现特雷普利单克隆抗体销售收入约2.98亿元其中,第一季度销售收入较2021年第四季度增长约212%虽然4—5月受上海,吉林疫情影响,第二季度销售收入仍比第一季度增长70%左右到6月底,君实生物商业化团队已经超过1100人
今年5月,Tereplizumab一线食管鳞状细胞癌适应症获批,这是Tereplizumab在中国获批的第五个适应症此外,Tereplizumab一线治疗非小细胞肺癌的适应症正在评估后期,有望年内获批与之前批准的适应症如黑色素瘤相比,这两个适应症对更广泛的患者群来说是大适应症
值得注意的是,与其他国产PD—1不同的是,君实生物在各种肿瘤类型的一线治疗之外,还广泛布局围手术期治疗/术后辅助治疗领域,覆盖了国内高发的肿瘤类型,包括胃癌,肝癌,肺癌,食管鳞状细胞癌目前已全部进入三期临床试验阶段,公司成为进入时间最早,开展辅助/围手术期治疗临床试验适应症最广的本土药企根据消息显示,特立普利辅助治疗肝癌的三期临床试验有望在下半年读出数据目前国际上还没有肝癌辅助治疗的三期临床成功
目前,辅助/围手术期治疗的适应症正在成为PD—1研发的新战场券商研报认为,伴随着人们防癌意识的提高和癌症早期筛查的普及,早期癌症患者占多数,预计目标人群将持续增长,辅助/新辅助治疗市场空间潜力巨大,预计到2030年,国产PD—1辅助新辅助将针对主要肿瘤物种,目标治疗人群超过88万人,市场规模将达到约107.2亿元
流水线布局解决免疫治疗三大难题
对于商业化初期的创新型药企来说,管道的布局和潜力比业绩更值得关注半年报显示,2022年上半年,君实生物R&D费用总额达10.62亿元,同比增长12.14%
在独立R&D投资的持续增加下,君实生物上半年进一步扩大其R&D管道目前公司已开发在研药物50余个,其中近30个处于临床试验阶段,包括安哥拉昔康,VV116,贝伐单抗,PARP抑制剂等处于三期重点注册临床试验阶段的品种,以及20余个处于临床前开发阶段的产品
值得注意的是,在其R&D管道中,有许多创新的一流或一流的药物例如,Angorixicam和UBP1213是中国美国食品药品监督管理局IND批准的第一个抗PCSK9单克隆抗体和抗BLyS单克隆抗体TAB004/JS004是君实自主研发的全球首个抗BTLA单克隆抗体它已经获得美国FDA和NMPA的批准,目前正在中国和美国进行二期临床试验
此外,在其他研究品种中,还有潜在的临床早期全球新药物,如CD112R单克隆抗体TAB009/JS009,CD39单克隆抗体JS019,CD93单克隆抗体JS013公司布局的药物种类也很丰富,涵盖单克隆抗体,小分子,多肽药物,抗体药物缀合物,双特异性或多特异性抗体,核酸药物等
为什么真实的生物如此布局。在8月初举行的证券时报生物医药创新论坛暨第二届医药创新奖颁奖大会上,君实生物全球R&D总裁邹建军博士是这样解释的:
目前免疫治疗还有三大问题需要解决第一,PD—1抗体治疗后有耐药性,第二,免疫疗法对冷肿瘤无效,第三,很多患者缺乏或仅有少量肿瘤特异性T细胞,无法产生免疫反应君实生物的肿瘤流水线布局,主要是围绕这三大难题进行突破通过对肿瘤免疫治疗研究的不断深入,开发出协同互补的免疫肿瘤药物组合,让更多患者受益于肿瘤免疫治疗
出海步伐再次加快
最近几年来,伴随着国内医药生物产业的蓬勃发展,以及创新实力和产品质量的基础,出海成为众多生物医药企业的直接目标。
在国际化布局中,君实生物率先尝到了出海的果实去年上半年,君实生物营收的爆发式增长主要得益于新冠肺炎中和抗体Etsiweizumab对外授权营收的增长通过与美国礼来公司的合作,Etsvilizumab已于2021年在超过15个国家获得许可
继该药之后,曲普利的海外发行也有望迎来收获期。
今年7月,FDA接受了重新提交的Tereplizumab用于鼻咽癌适应症的上市申请根据消息显示,FDA已将处方药用户支付账单的目标审查日期定为2022年12月23日如果成功获批,君实生物的北美合作伙伴Coherus计划于2023年第一季度在美国推出TereplizumabTereplizumab也将成为美国首个也是唯一一个用于鼻咽癌治疗的肿瘤免疫药物
此外,君实生物持续推动创新药物在海外的临床应用日前,君实生物发布公告称,公司与微环境生物联合研发的XPO1抑制剂WJ01024片临床试验申请获得美国FDA批准截至目前,君实生物R&D管道上的7个创新药物已在美国获批临床试验
可是,海外临床研究不仅需要很高的R&D实力,还需要巨大的投资成本。
为进一步加大创新药研发投入,今年6月,君实生物公布了近40亿元的定增方案其中,君实生物拟将募集资金36.71亿元用于创新药物的临床研究和临床前研究,包括JS001后续境内外临床研发,JS004境内外三期临床研发,JS111境内外临床研发,其他早期项目的临床前研究等临床研发项目
君实生物表示,该项目将进一步丰富公司研究药物产品的管道,快速推进临床药物的境内外临床试验,促进临床前药物的发展,为加快研究产品上市注册进程奠定基础。
。声明:本网转发此文章,旨在为读者提供更多信息资讯,所涉内容不构成投资、消费建议。文章事实如有疑问,请与有关方核实,文章观点非本网观点,仅供读者参考。
 精彩推荐
精彩推荐
 每周热点
每周热点










